原子スペクトル分析
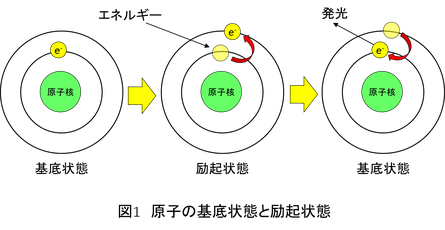
化学分析において原子スペクトル分析はとても重要な原理です。原子は原子番号、電子の数、原子半径など固有の特性を数多く有しています。そして元素固有の特性の1つに原子スペクトルがあります。ボーアの量子条件によると、原子核の周りの電子は決まった軌道を円運動します。電子はエネルギーを持っていて、この電子軌道をエネルギー準位といいます。ここで原子にエネルギーを与えると、電子の円軌道が外側の円軌道に移動して、高いエネルギー準位になります。この現象を励起と呼びます。また、励起される前のエネルギーの低い状態を基底状態と呼びます。この模式図を図1に示します。励起された原子は励起状態(B)を長く維持できず、基底状態(A)に戻ろうとします。そして、励起状態から基底状態に戻る時にはエネルギー準位も変化します。この時のエネルギーの差は発光スペクトルとして放出されます(C)。これを式(1)に示します。
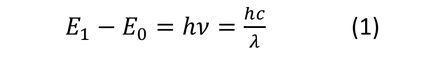
E1、E0:それぞれのエネルギー準位
h:プランク定数 6.63×10-34Js
ν:振動数
c:光速度 3.00×108m/s
λ:波長
原子スペクトル分析において、基底状態から励起状態に変化する時のエネルギー準位(波長や振動数)は原子固有であるため、波長や振動数から定性分析が行われます。そして、発光スペクトルの強度は原子の存在量によって変化するため、発光スペクトルの強度に基づいて定量分析が行われます。
コメントをお書きください