電位-pH図
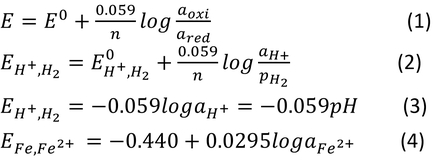
ネルンストの式(1)において、標準水素電極反応を仮定すると(2)式のようになります。そしてE0=0V、pH2=1のため(3)式のように表せます。すなわち、標準水素電極は溶液のpHによって電位が変化することを表します。そしてネルンストの式(3)を鉄に対して表すと(4)式のようになります。そして、水素電極以外の溶存酸素をともなう反応、鉄のイオン溶出以外の酸化膜をともなう反応などを全て電位とpHに対してプロットしたものが電位-pH図と呼ばれるものです。鉄の電位-pH図を図1に示します。電位-pH図は鉄以外の様々な金属に対しても作られています。

電位-pH図において主に重要となるのが鉄(金属)の安定域、腐食域、不動態域の3種類です。安定域の電位では腐食されません。腐食域では鉄が溶出するので腐食されます。不動態域では生成した酸化膜によって腐食環境から保護されます。また電位-pH図には通常、溶存酸素、水素発生反応も合わせて表記されます。この二つの直線の間が水の安定領域と言えます。電気化学的な観点から鉄の電位を安定域まで卑にすれば鉄は腐食されずに金属として安定します。これがカソード防食の考え方になります。またpHをアルカリ側に移動することで不動態域にして防食するという考えもあります。
コメントをお書きください